La solution aqueuse de peroxyde d’hydrogène est l’eau oxygénée, utilisée dans de nombreux domaines, du blanchiment de la pâte à papier à son action d’antiseptique pharmaceutique.
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Distances interatomiques, en phase gazeuse |
Angles, en phase gazeuse |
Moment dipolaire |
| H2O2 | 34,01 g.mol-1 | O-O : 147 pm O-H : 95 pm |
OO-H : 94,8° les H étant situés dans 2 plans faisant un angle de 115,5° | 1,573 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Solubilité dans l’eau |
| 1,442 g.L-1 | -0,41°C | 150,2°C | infinie |
Données chimiques
| pKa : H2O2/HO2– | E° : O2(g) + 2H+ + 2e = H2O2 | E° : H2O2 + 2H+ + 2e = 2H2O |
| 11,65 | 0,69 V | 1,77 V |
Données thermodynamiques
Peroxyde d’hydrogène liquide :
|
Peroxyde d’hydrogène gazeux :
Peroxyde d’hydrogène en solution aqueuse :
|
Données industrielles
La solution aqueuse de peroxyde d’hydrogène est l’eau oxygénée.
Matières premières
Le dioxygène de l’air et le dihydrogène.
Le dihydrogène utilisé pour fabriquer le peroxyde d’hydrogène et sa solution aqueuse, l’eau oxygénée, doit être d’une grande pureté. Souvent celui employé est coproduit lors de l’électrolyse du chlorure de sodium afin d’obtenir le dichlore, l’hypochlorite de sodium ou le chlorate de sodium. Par exemple, l’usine de Jarrie (38) exploitée par Arkema en France, utilise du dihydrogène coproduit lors de la fabrication de chlorate de sodium.
Fabrication industrielle
Elle est réalisée, quasi exclusivement, selon le procédé d’auto-oxydation basé sur la réduction d’une alkylanthraquinone en anthraquinol suivie de son oxydation. Lors de cette réaction, l’anthraquinone est régénérée et le peroxyde d’hydrogène se forme.
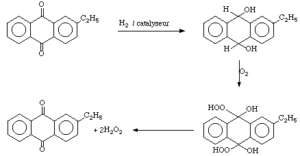
La solution d’alkylanthraquinone, en général l’éthyl-2 anthraquinone, dans un solvant organique non miscible dans l’eau est hydrogénée en présence de catalyseur (palladium sur alumine) en hydroquinone qui est oxydée par le dioxygène de l’air en un mélange d’hydroxyhydroperoxydes qui sont décomposés en H2O2 et quinone de départ qui est recyclée. H2O2 est séparé de la phase organique par extraction à l’eau (à ce niveau la concentration en H2O2 peut atteindre 47 % en masse), puis concentré par distillation afin d’obtenir les diverses solutions commerciales, en général à 70 % en masse soit 900 g de H2O2/L de solution.
Les pressions sont proches de la pression atmosphérique et les températures d’hydrogénation et d’oxydation comprises entre 60 et 80°C. Le rendement par rapport au dihydrogène est supérieur à 95 %. Des réactions secondaires entraînent une faible consommation d’anthraquinone qui peut être notablement réduite par l’utilisation d’un traitement catalytique annexe de reconversion. Les réactions de production de H2O2 étant exothermiques, les réacteurs, en aluminium ou acier inoxydable, sont refroidis par de l’eau.
Capacités des unités de production : on distingue 3 types d’usines.
- Des méga-usines, avec des capacités de production comprises entre 200 000 et 350 000 t/an destinées à produire de l’oxyde de propylène, pour, principalement, la fabrication de polyuréthane ou de propylène glycol, par réaction entre le propylène et le peroxyde d’hydrogène, selon le procédé HPPO, par exemple pour celles exploitées, en joint venture, par Solvay, en Belgique, à Anvers (230 000 t/an), en Thaïlande, à Map Ta Phut (330 000 t/an) et en Arabie Saoudite, à Jubail (300 000 t/an). La première méga-usine a été construite, en 2008, par Evonik, à Ulsan, en Corée du Sud pour alimenter l’usine de SKC.
- Des usines standards avec des capacités de production de 70 000 à 100 000 t/an.
- Des productions sur site, en général de production de pâte à papier, possédant des capacités de production plus faibles, de 8 000 à 18 000 t/an, par exemple pour Solvay avec 12 000 t/an destinées à la société Suzano Papel e Celulose à Imperatriz, dans l’État de Maranhão au Brésil.
Conditionnement :
Il est réalisé dans des citernes ou des fûts en aluminium, acier inoxydable austénitique (par exemple 304 L) ou polyéthylène haute densité. Les concentrations les plus couramment commercialisées par les producteurs sont de 35 et 70 % de H2O2 (des concentrations de 85 % peuvent être livrées).
Définition de la concentration des solutions de H2O2, exprimée en volume : c’est le nombre de litres de dioxygène gazeux mesuré à 0°C et 1 atm donné par un litre de solution de H2O2 à 20°C selon l’équation chimique :
2 H2O2 = 2 H2O + O2
| Teneur en H2O2 en g pour 100 g de solution | 3 | 30 | 70 |
| Concentration en volume | 10 | 110 | 298 |
| Masse volumique à 25°C en g.cm-3 | 1,007 | 1,108 | 1,284 |
Propriétés
La propriété la plus utilisée des solutions de H2O2 est le pouvoir oxydant qui permet d’oxyder de nombreux composés organiques (colorants…) et minéraux. H2O2 est également réducteur vis à vis d’agents oxydants forts. Il peut former, par transfert du groupement peroxyde, d’autres peroxydes organiques ou inorganiques. Il peut également former des composés d’addition (perborates et percarbonates) et donner du dioxygène et de l’eau par décomposition.
Ces propriétés en font un agent de blanchiment « écologique », les produits formés, dioxygène et eau, étant non polluants.
Stabilité : les solutions commerciales de H2O2 sont stables tant qu’elles restent pures, mais de nombreux facteurs agissent sur leur stabilité.
- Catalyseurs de décomposition : la plupart des métaux (sauf l’aluminium et l’acier inoxydable) et en particulier : Fe, Cu, Ni, Zn, Mn, Cr, V, W, Mo, Ag, Pt, les oxydes et hydroxydes des métaux lourds, à de très faibles teneurs (de l’ordre de quelques ppm), suffisent souvent à provoquer une décomposition rapide. Pour cette raison, H2O2 doit être dilué à l’aide d’eau déminéralisée et non distillée (la distillation étant souvent effectuée dans des appareils en cuivre). Afin de minimiser la décomposition de H2O2 entraînée par une possible pollution, des stabilisants (complexants de métaux, par exemple du pyrophosphate de sodium) sont ajoutés aux solutions commerciales.
- L’élévation de température, la lumière, des pH > 5 favorisent également la décomposition.
Productions
Elles sont, en général, exprimées en H2O2 à 100 %, sauf pour les données sur le commerce international collectées par l’ITC.
En 2015, les capacités de production mondiales sont estimées à 5,5 millions de t/an.
En 2022, la production de l’Union européenne a été de 1,076 million de t dans les pays suivants :
| Belgique | 281 442 | Pays Bas | 95 918 | |
| Suède, en 2021 | 206 497 | Italie | 49 037 | |
| Allemagne | 138 634 | Espagne | 44 839 | |
| Finlande | 126 256 | Portugal | 43 865 |
Pour les autres pays de l’Union européenne, dont la France, les productions sont confidentielles ou nulles.
En 2017, la production du Canada est de 239 452 t, celle du Japon, en 2018, de 179 540 t, celle de l’Inde, en 2019, de 156 540 t.
| Belgique | 222 446 | Suède | 123 512 | |
| Corée du Sud | 182 721 | Allemagne | 108 963 | |
| Brésil | 144 915 | Autriche | 84 281 | |
| Pays Bas | 143 998 | Canada | 82 500 | |
| Thaïlande | 132 736 | France | 71 877 |
| Allemagne | 212 726 | Israël | 65 087 | |
| Pays Bas | 89 086 | Chili | 64 903 | |
| États-Unis | 87 250 | Vietnam | 54 357 | |
| Taipei chinois | 82 303 | Belgique | 52 486 | |
| France | 67 937 | Autriche | 52 132 |
Principaux producteurs : en 2018.
| Solvay (Belgique) | 1 365 | Arkema (France) | 440 | |
| Evonik Industries (Allemagne) | 950 | Peroxychem (États-Unis) | 200 | |
| Mitsubishi Gas Chemical (Japon) | 489 | Nouryon (Pays Bas) | 200 |
Sources : Merchant Research & Consulting et rapports des sociétés
Solvay, n°1 mondial, produit H2O2 dans 18 usines, en Belgique (Jemeppe sur Sambre et Zandvliet (Anvers) dans une joint venture avec BASF et Dow avec 230 000 t/an), aux Pays Bas (Linne Herten), au Royaume-Uni (Warrington), au Portugal (Povoa de Santa Iria), en Allemagne (Bernburg), en Italie (Rosignano), en Finlande (Voikkaa), aux États-Unis (Deer Park (LaPorte) au Texas et Longview dans l’État de Washington, avec 187 000 t/an), en Chine (à Zhenjiang, province de Shandong avec 60 000 t/an), en Australie (Banksmeadow (Sidney)), en Thaïlande (Map Ta Phut en joint venture avec Dow avec 330 000 t/an), en Arabie Saoudite (Jubail, avec 300 000 t/an), en association avec Sadara (joint venture entre Saudi Aramco et Dow). Au Brésil, à Curitiba, dans l’État de Paraná, Solvay détient 70 % d’une joint venture, Peróxidos do Brasil, en association pour 30 % avec Produtos Químicos Makay, avec une capacité de production de 230 000 t/an.
Evonik, n°2 mondial, avec une capacité de production de 950 000 t/an exploite 13 usines à travers le monde, aux États-Unis à Mobile dans l’Alabama, au Canada, à Gibbons dans l’Alberta et Maitland dans l’Ontario, en Afrique du Sud à Umbogintwini, au Brésil à Barra do Riacho, en Chine dans la province de Jilin, pour produire de l’oxyde de propylène selon le procédé HPPO, avec 230 000 t/an, en Corée du Sud à Ulsan, pour produire de l’oxyde de propylène selon le procédé HPPO, en Indonésie à Cikarang, en Nouvelle Zélande à Morrinsville, en Allemagne à Rheinfelden, en Belgique à Anvers, en Autriche à Weissenstein, aux Pays Bas à Delfzijl. En février 2020 a finalisé l’achat de Peroxychem (ex-FMC) avec des unités de production aux États-Unis, à Bayport au Texas et Saratoga Springs dans l’État de New York, en Espagne à La Zaida, dans la province de Zaragoza et dans une joint-venture, en Thaïlande à Saraburi avec Aditya Birla, avec 19 000 t/an. L’usine canadienne de Peroxychem de Prince George, en Colombie Britannique, non comprise dans l’achat, a été vendue à United Initiators.
Mitsubishi Gas Chemical produit du peroxyde d’hydrogène de pureté standard au Japon, à Yokkaichi, avec 18 000 t/an, Kashima, avec 104 000 t/an et Tomakomai, avec 33 000 t/an, en Indonésie, avec 12 000 t/an et en Chine avec 30 000 t/an. Par ailleurs, produit du peroxyde d’hydrogène ultra pur, au Japon à Yamakita, avec 30 000 t/an, Saga, avec 19 000 t/an et Yokkaichi, avec 12 000 t/an, en Corée du Sud, avec 120 000 t/an, à Singapour, avec 10 000 t/an, à Taipei chinois, avec 31 000 t/an et aux États-Unis, avec 70 000 t/an. Deux nouvelles usines de production de produit ultra pur, de 35 000 t/an chaque, ont été construites en 2019, dans l’Oregon et le Texas.
Arkema exploite 5 usines dont, en France, l’unité de production de Jarrie (38), d’une capacité de 115 000 t/an. Produit également H2O2 au Canada à Bécancour, au Québec, avec 80 000 t/an de capacité, aux États-Unis, à Memphis dans le Tennessee, avec 70 000 t/an, en Chine, à Shanghai avec 66,6 % d’une joint venture avec Shangai Coking and Chemical Corporation (SCCC) et 80 000 t/an, ainsi qu’en Allemagne à Leuna, près de Leipzig avec 80 000 t/an.
Nouryon issu en octobre 2018 de AkzoNobel produit du peroxyde d’hydrogène en Norvège, à Rjukan, en Suède, à Bohus et Alby et aux États-Unis, à Colombus dans le Mississippi, avec une capacité de production de 64 000 t/an.
Situation française
Capacités de production : 115 000 t/an, par Arkema à Jarrie (38).
Commerce extérieur : en 100 % H2O2, en 2023.
Les exportations s’élevaient à 37 078 t à destination principalement à :
- 32 % d’Allemagne,
- 19 % d’Espagne,
- 17 % d’Italie,
- 10 % de Suisse,
- 5 % de Suède.
Les importations s’élevaient à 31 026 t en provenance principalement à :
- 40 % d’Allemagne,
- 24de Belgique,
- 17 % des Pays Bas,
- 12 % d’Espagne.
Utilisations
Consommation : dans le monde, en 2020, 5,187 millions de t. Répartition de la consommation, en 2021 :
| Chine | 45 % | Amérique du Nord | 10 % | |
| Europe de l’ouest | 16 % | Autres pays asiatiques | 8 % |
Source : IHS Markit
Secteurs d’utilisation du peroxyde d’hydrogène
En 2020, dans le monde (source : Mordor Intelligence)
Utilisations diverses :
- Blanchiment des pâtes à papier : H2O2 est utilisé pour les pâtes mécaniques, il se substitue partiellement à Cl2, ClO2 et HClO pour les pâtes chimiques. Il s’emploie dans tous les procédés de désencrage des vieux papiers. Les consommations moyennes de H2O2 sont, pour une tonne de pâte, de 0,9 kg en association avec Cl2, de 4,1 kg en association avec ClO2 et de 20 kg pour les pâtes sans chlore (« totally chlorine-free »). Voir le chapitre consacré au chlorate de sodium.
- Blanchiment des textiles : fibres cellulosiques naturelles, laine, soie, fibres artificielles… De 80 à 90 % des fibres de coton sont blanchies à l’aide de solutions aqueuses de peroxyde d’hydrogène à une teneur comprise entre 0,3 à 0,6 %, à pH de 10,5 à 11,5 et à 90-95°C.
- Fabrication de produits de blanchiment pour poudres de lavage : perborates de sodium mono et tétrahydratés et percarbonate de sodium. Ils entrent à des teneurs de 15 à 20 % en masse dans les lessives (voir le chapitre consacré aux borates).
- La production d’oxyde de propylène, destiné principalement à la production de polyuréthane et de propylène glycol, par réaction entre le propylène et le peroxyde d’hydrogène, selon le procédé HPPO (Hydrogen-Peroxide-to-Propylene-Oxide), se développe et diverses usines de production de peroxyde d’hydrogène destinées à cet usage ont été construite, par exemple, en 2008, par Solvay, BASF et Dow, à Anvers, en Belgique et par Evonik à Ulsan en Corée du Sud. Ce procédé permet de produire de l’oxyde de propylène sans coproduction de styrène ou d’alcool tertiobutylique, selon la réaction :
CH2CH3CH + H2O2 = CH3C2H3O + H2O
- Traitement des eaux usées : H2O2 permet, en particulier, d’éviter la formation de H2S dans les eaux usées (si le milieu est anaérobie), de détruire les ions cyanures, nitrites, les phénols…
- Traitement des eaux potables : par exemple, le sud de la ville de Sao Paulo (Brésil) est alimenté avec un débit de 16 m3.s-1 par un lac artificiel où des algues prolifèrent. Une pulvérisation de H2O2 traitant 1 km2.h-1 élimine ces algues.
- Désulfuration et dénitrification des fumées, par lavage des gaz.
- Métallurgie : H2O2, décomposé rapidement en présence d’ions métalliques, est utilisé après avoir été transformé en acide de Caro (acide peroxomonosulfurique). L’opération est, en général, effectuée sur les lieux d’utilisation selon la réaction :
H2O2 + H2SO4= H2SO5 + H2O.
L’acide de Caro est utilisé pour oxyder U+IV insoluble en U+VI soluble, lors des opérations d’extraction de l’uranium de son minerai, pour séparer Co2+ de solutions de Ni par formation d’hydroxyde de Co3+ insoluble, pour séparer Mn2+ de solutions de Co et Zn par formation de MnO2 insoluble…
- H2O2 est également utilisé pour décaper les tôles et fils d’acier inoxydable en remplacement de l’acide nitrique (procédé UG3P – Ugine Peroxyd Pickling Process, mis au point par Ugine à Gueugnon). Consommation de 1 à 2 kg de H2O2/t d’acier.
- Chimie : synthèse de l’acide peracétique, de l’huile de soja époxydée utilisée comme stabilisant du PVC, d’hydrazine, d’hydroquinone et de pyrocatéchol par hydroxylation de noyaux aromatiques, de peroxydes organiques et inorganiques.
- Antiseptique pharmaceutique : c’est une de ses plus anciennes applications, il est hémostatique et bactériolytique.
- Stérilisation, en phase vapeur, des matériels et emballages agroalimentaires : lait UHT, jus d’orange… en emballages carton.
- Décontamination in situ des sols par injection d’eau oxygénée, par exemple, en Alsace, sur le site de l’ancienne raffinerie d’Herlisheim.
- Lutte contre la pandémie au covid-19 : la solution hydro-alcoolique d’antisepsie des mains recommandée par l’OMS a la composition suivante pour un volume de 10 litres : éthanol à 96 % : 8 333 mL, peroxyde d’hydrogène à 3 % : 417 mL, glycérol à 98 % : 145 mL, compléter à 10 L avec de l’eau permutée ou de l’eau bouillie refroidie.
- Le peroxyde d’hydrogène de haute pureté est employé pour nettoyer et graver les plaques de silicium en microélectronique. Solvay exploite deux unités en Asie (à Suzhou en Chine et Map Ta Phut en Thaïlande), une unité aux États-Unis à Deer Park (Texas) ainsi qu’une unité à Bernburg en Allemagne. Les produits peroxydés de haute pureté produits dans ces sites, ont des teneurs en impuretés variant de moins de 100 ppb à moins de 0,1 ppb en cations contaminants.
Bibliographie
- J.M. Campos-Martin, G. Blanco-Brieva, J.L.G. Fierro, « Hydrogen peroxide synthesis : an outlook beyond the anthraquinone process« , Angew. Chem. Int. Ed., 2006, 45, 6962-6984.
- F. Schmidt, et al, « HPPO process technology. A novel route to propylene oxide without coproducts », Chimica Oggi, vol 32 (2), mars/avril 2014.
- Formulation des produits hydro-alcooliques recommandés par l’OMS.
Archives