Le dioxygène est indispensable à la vie sur terre. Il est principalement extrait des gaz de l’air par distillation cryogénique. Sa principale utilisation, dans la sidérurgie, s’est développée après la construction d’un réseau de canalisations de transport du gaz.
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Distance interatomique |
| O2 | 31,998 g.mol-1 | 121 pm |
Données physiques
| Masse volumique | Température de fusion | Température de sublimation | Température critique | Pression critique | Température point triple | Pression point triple | Conductibilité thermique | Solubilité dans l’eau |
|
-218,4°C | -182,96°C | -118,57°C | 5 043 kPa | -218,79°C | 0,15 kPa | 0,02674 W.m-1K-1 |
|
Données chimiques
| pKa : HO2/O2– | pKa : HO/O2– |
| 4,4 | 12 |
Potentiels standards :
| O3(g) + 2H+ + 2e = O2(g) + H2O | E° = 2,07 V |
| O2(g) + 2H+ + 2e = H2O2 | E° = 0,69 V |
| O2(g) + H2O + 2e = OH– + HO2– | E° = -0,076 V |
| O2(g) + 4H+ + 4e = 2H2O | E° = 1,229 V |
| O2(g) + 2H2O + 4e = 4OH– | E° = 0,401 V |
Données thermodynamiques
Dioxygène gazeux :
|
Dioxygène en solution aqueuse :
|
Données industrielles
État naturel
L’oxygène est l’élément le plus répandu sur terre. Il représente :
- 46,4 %, en masse, de la croûte terrestre, sous forme d’oxydes, silicates…
- 88,9 %, en masse, de l’eau (dans la molécule H2O), ainsi que sous forme de dioxygène, en solution (8 mg/L à 20°C).
- 62,5 %, en masse, du corps humain (88 % chez certains animaux marins) principalement dans la molécule d’eau.
- 23,1 %, en masse, de l’air, sous forme de dioxygène, soit 1,2 1015 t.
Composition de l’air sec
(en % volume et masse. Masse de l’atmosphère : 5,13 1015 t)
| Gaz | % en volume | % en masse | Gaz | % en volume | % en masse | |||
| Diazote | 78,09 | 75,52 | Krypton | 1,0.10-4 | 3,3.10-4 | |||
| Dioxygène | 20,95 | 23,14 | Dihydrogène | 5,0.10-5 | 0,3.10-5 | |||
| Argon | 0,93 | 1,29 | Hémioxyde d’azote | 2,7.10-5 | 4,1.10-5 | |||
| Dioxyde de carbone | 0,03 | 0,05 | Oxyde de carbone | 1,9.10-5 | 1,9.10-5 | |||
| Néon | 1,8.10-3 | 1,3.10-3 | Xénon | 8,0.10-6 | 40.10-6 | |||
| Hélium | 5,2.10-4 | 0,7.10-4 | Ozone | 1,0.10-6 | 1,6.10-6 | |||
| Méthane | 1,5.10-4 | 0,8.10-4 | Radon | 6,0.10-18 | 50.10-18 |
La teneur moyenne en vapeur d’eau est de 0,53 % en volume (0,33 % en masse) et varie de 0,1 % en Sibérie à 5 % dans des régions côtières équatoriales.
Épaisseur de l’atmosphère : en % de la masse atmosphérique située au-dessous d’une altitude donnée.
| 50 % | 67 % | 75 % | 90 % | 99 % | ||||
| 5 500 m | 8 400 m | 10 300 m | 16 100 m | 31 000 m |
Fabrication industrielle
L’obtention du dioxygène est réalisée principalement (à 95 %) par voie cryogénique par séparation des gaz de l’air.
Principe de la voie cryogénique : par liquéfaction de l’air suivie d’une distillation fractionnée.
Les températures critiques du diazote (tc = – 146,9°C) et du dioxygène (tc = – 118,4°C) ne permettent pas la liquéfaction de l’air par simple compression. L’air, comprimé entre 5 et 7 bar, est filtré, séché, décarbonaté par adsorption sur tamis moléculaires puis refroidi par échange thermique entre le gaz entrant et les gaz liquéfiés. Les pertes frigorifiques sont compensées par détente de 5 à 10 % du débit gazeux traité dans une turbine avec travail extérieur récupérable.
La distillation, dans le procédé le plus utilisé, est effectuée dans une double colonne qui permet d’obtenir, en continu, des gaz purs. La première colonne, sous une pression moyenne de 5 bar, réalise une première séparation de l’air en diazote gazeux pur (99,999 %) au sommet et un liquide riche en dioxygène, avec une teneur d’environ 40 %, à la base, qui est envoyé à mi-hauteur de la deuxième colonne sous une pression basse de 1,3 bar. Le dioxygène à 99,5-99,7 % est récupéré à la base de cette colonne. Il contient moins de 1 ppm de diazote, la principale impureté est l’argon.
Les colonnes ont entre 1 et 6 m de diamètre et de 15 à 25 m de hauteur. Elles sont en acier inoxydable ou en aluminium et comportent une centaine de plateaux. L’isolation thermique est réalisée avec de la perlite, le maintien en température ne consomme que 6 à 7 % de l’énergie totale dépensée.
La consommation d’énergie est de 0,4 kWh/m3 de O2 gazeux, soit de 50 à 60 % du prix de revient.
Les capacités de production des unités les plus importantes, appelées oxytonnes, atteignent 5 000 t de O2/jour et 8 000 t de N2/jour.
Début 2018, est entré en production une unité de 5 000 t O2/jour, la plus importante dans le monde, construite et exploitée par Air Liquide, à Secunda, en Afrique du Sud, afin d’approvisionner le groupe chimique Sasol. Au total, Air Liquide fournit à Sasol, 45 000 t/jour de dioxygène.
En France, la première production industrielle de dioxygène a été effectuée par Georges Claude, le 23 avril 1905 à Boulogne-Billancourt. Il a recueilli 280 m3 de O2 à 93 % de pureté.
La distillation des gaz de l’air produit simultanément O2, N2, ainsi que des gaz rares, le principal étant l’argon, avec une teneur de 0,93 % en volume dans l’air. La production est commandée par le gaz le plus demandé, l’excès de production des autres gaz étant relâché dans l’atmosphère.
Exemple de l’usine Air Liquide de Seraing (Liège, Belgique) connectée au réseau nord européen de cette société. La capacité est de 1 100 t/jour de dioxygène.
| Capacité (m3/h) | Pureté | ||
| Dioxygène gazeux | 30 600 | 99,6 % | |
| Diazote gazeux | 40 500 | 1 ppm de O2 maximum | |
| Argon liquide | 1 170 | 5 ppm d’impuretés | |
| Diazote liquide | 17 500 | 1 ppm de O2 maximum | |
| Dioxygène liquide | 250 | 5 ppm d’impureté maximum |
Procédé non-cryogénique :
Il est dénommé VPSA (Vacuum Pressure Swing Adsorption) ou adsorption par alternance de pression et vide. L’air, à la pression atmosphérique, après séchage et épuration par filtration, passe dans une colonne de zéolithes qui adsorbent plus rapidement N2 que O2. Les zéolites, par kg, peuvent fixer 10 L de diazote. Lorsqu’elles sont saturées, l’air est envoyé sur une seconde colonne, pendant que le N2 de la première colonne désorbe sous vide. La pureté de O2 obtenu ainsi par élimination de N2 peut atteindre 90 à 95 %. Il contient 4,5 % d’argon qui comme O2 n’est pas adsorbé. La consommation d’énergie est de 0,4 à 0,5 kWh/m3 de O2. Ce procédé est de plus en plus employé dans des procédés industriels dont les besoins sont d’environ 1000 t/jour, ainsi que, par exemple, dans les respirateurs utilisés à domicile.
Choix des diverses sources d’approvisionnement : en fonction de la pureté et du débit souhaités.
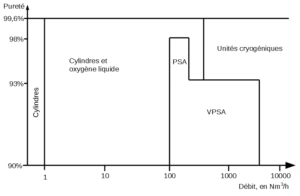
Conditionnement et distribution : le dioxygène, ainsi que le diazote et l’argon, sont produits, par voie cryogénique, dans un nombre réduit d’unités de production (une vingtaine en France) et distribués selon trois modes :
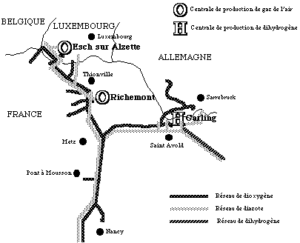
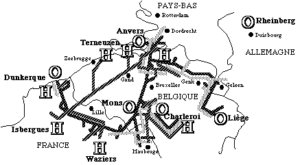
- Par oxyducs : en France, environ 45 % de la production industrielle de dioxygène est acheminée par canalisation. Le réseau mondial de canalisations de dioxygène et de diazote, en Allemagne, Benelux, États-Unis, France (dans le Nord et en Lorraine, voir cartes ci-dessous), Royaume Uni, Italie… est de plus de 8 500 km dont 5 500 km exploités par Air Liquide, 1 200 km par Air Products, 1 120 km par Taiyo Nippon Sanso, 500 km par Messer.
Réseau Est d’Air Liquide (d’après un document de cette société que nous remercions)
Réseau Nord d’Air Liquide (d’après un document de cette société que nous remercions)
- Par camions, sous forme liquide, dans un rayon de 200 à 250 km : environ 35 % de la production française.
- Comprimé en bouteilles, à 200 bar : environ 20 % de la production française. Les bouteilles sont remplies, par des centres de conditionnement, à partir de liquide livré par camion.
- Le dioxygène et le diazote peuvent également être produits in situ, principalement par voie non-cryogénique, dans des unités destinées à approvisionner directement un utilisateur.
Productions
Dans le monde, la production est estimée à 300 millions t/an soit 2,5/10 millions du dioxygène de l’atmosphère.
En 2022, la production de l’Union européenne est de 34,246 millions de t* dont :
| Allemagne | 8 431 | Belgique | 2 062 | |
| Pays Bas | 4 182 | Finlande | 1 404 | |
| Italie | 3 213 | République tchèque | 1 170 | |
| Espagne | 2 324 | Autriche | 1 164 | |
| Pologne | 2 187 | Roumanie | 561 |
Source : statistiques Prodcom de l’Union européenne
* : les données statistiques de l’Union européenne sont exprimées en m3, dans les conditions normales (0°C, 1,013 bar), dans ces conditions la masse volumique du dioxygène est de 1,4287 kg.m–3.
La production française est confidentielle, ainsi que celle de la Slovaquie.
En 2020, la production du Japon est de 13,877 millions de t.
Évolution de la demande annuelle de gaz de l’air aux États-Unis :
| Années | Dioxygène | Diazote | Argon | |||
| 1966 | 10 millions de t | 3 millions de t | 100 000 t | |||
| 1981 | 16 millions de t | 16 millions de t | ||||
| 1985 | 15 millions de t | 24 millions de t | 500 000 t | |||
| 1996 | 27 millions de t | 36,5 millions de t | ||||
| 2004 | 29,3 millions de t | 33,4 millions de t |
Commerce international : en 2022.
Principaux pays exportateurs :
| Belgique | 436 143 | Portugal | 50 371 | |
| France | 266 585 | Koweït | 45 538 | |
| Allemagne | 63 308 | Croatie | 23 178 | |
| Autriche | 53 720 | Bulgarie | 22 827 | |
| Pologne | 51 872 | Slovénie | 16 195 |
Source : ITC
Les exportations belges sont destinées à 73 % aux Pays Bas, 24 % à la France.
Principaux pays importateurs :
| Allemagne | 206 692 | Jordanie | 48 409 | |
| Luxembourg | 157 209 | Grèce | 43 935 | |
| Slovaquie | 68 298 | Slovénie | 35 287 | |
| Pays Bas | 59 800 | France | 21 940 | |
| Canada | 59 800 | Portugal | 18 145 |
Source : ITC
Les importations allemandes proviennent à 61 % de France, 13 % d’Autriche, 8 % de République tchèque.
Principaux producteurs : environ 60 % de la production de dioxygène est assurée directement par les industries consommatrices.
- Linde : AGA (Suède) et BOC (Royaume-Uni) ont été racheté par Linde respectivement en 2000 et 2006. La fusion entre Linde et Praxair est effective depuis fin 2018. Le groupe après fusion est devenu n°1 mondial des gaz industriels avec environ 24 % du marché, suivi par Air Liquide avec 18 %, Air Products avec 7 %. Les utilisations captives représentant 31 %. Linde exploitait 320 grandes unités cryogéniques de séparation des gaz de l’air, dont 150 en Europe, Moyen Orient et Afrique, 110 en Asie, Pacifique et 60 en Amériques. Praxair était n°1 des gaz industriels en Amérique du Nord et du Sud et exploitait, en Europe, 60 grandes unités cryogéniques de séparation des gaz de l’air et 3 pipeline, au Nord de l’Espagne et en Allemagne dans la région rhénane et la Sarre. Exploitait en Amérique du Sud 50 grandes unités cryogéniques de séparation des gaz de l’air et 50 en Asie. Dans le cadre de cette fusion les usines européenne de Praxair ont été cédée à Nippon Gases, filiale de Taiyo Nippon Sanso et les 32 usines de liquéfaction des gaz de l’air de Linde aux États-Unis ont été cédées à Messer.
- Air Liquide : dans le monde, les capacités de production du groupe sont de plus de 130 000 t/jour, avec, en 2021, 373 grandes unités cryogéniques de séparation des gaz de l’air, dont 22 en Allemagne. En mai 2016, Air Liquide a finalisé l’acquisition du groupe américain Airgas.
- Air Products : exploite, dans le monde, plus de 300 grandes unités cryogéniques de séparation des gaz de l’air.
- Autres producteurs importants : Taiyo Nippon Sanso (filiale de Mitsubishi Chemical, Japon), Messer (Allemagne), Yingde (Chine), Hangzhou Hangyang (Chine).
Situation française
Production, en 2011 : 1,646 million de t.
Commerce extérieur : en 2023.
Les exportations étaient de 262 463 t avec comme principaux marchés à :
- 53 % l’Allemagne,
- 44 % le Luxembourg
- 2 % la Belgique.
Les importations s’élevaient à 31 652 t en provenance principalement à :
- 73 % de Belgique,
- 17 % d’Allemagne,
- 9 % de Suisse,
- 4 % d’Espagne.
Producteurs et sites de production :
- Air Liquide : 14 usines cryogéniques de séparation des gaz de l’air, en métropole et une usine à Kourou, en Guyane. Les usines de métropole sont située à :
- Moissy-Cramayel (77)
- Montoir-de-Bretagne (44)
- Sandouville (76)
- Pardies (64)
- Lacq (64)
- Tarnos (40)
- Richemont (57)
- Fos Tonkin (13) : la liquéfaction de l’air est assurée à l’aide du froid apporté par le gaz naturel liquéfié lors de sa regazéification dans les installation du terminal méthanier proche.
- Fos Audience (13)
- Pierrelatte (26)
- Feysin (69)
- Jarrie (38)
- Tavaux (39)
- Dunkerque (59).
- Air Products : à Schiltigheim (67) avec 650 t/j, L’Isle d’Abeau (38) avec 665 t/j, en association avec Messer et possède une participation de 50 % dans la société Soprogaz, en association avec Messer, qui exploite une usine à Beauvais (60) de 600 t/jour.
- Messer : à Beauvais (60), avec 300 t/jour, en association avec Air Products et Saint-Herblain (44), avec 300 t/jour, en association avec Linde. A repris, en mars 2014, les activités françaises de Praxair, avec les unités de production de Creil (60), avec 500 t/jour, L’Isle d’Abeau (38), avec 665 t/jour, en association avec Air Products et Strasbourg (67).
- Linde : usines de production à Salaise sur Sanne (38) et Montereau (77) ainsi qu’à Saint-Herblain (44), 300 t/jour, en association avec Messer.
Utilisations
Les principales utilisations sont les suivantes :
- Sidérurgie : c’est le principal secteur d’utilisation du dioxygène, dans l’élaboration de l’acier dans les convertisseurs mais aussi dans les hauts fourneaux. Cette industrie utilise environ la moitié de la production de O2 (la consommation est d’environ 60 m3 de O2 par t d’acier). Par exemple, Air Liquide approvisionne en dioxygène un important producteur mondial d’acier (Pohang Iron and Steel Company ou POSCO, Corée du Sud) à l’aide de 11 unités d’une capacité totale de 7 800 t/j.
- Combustions : le remplacement de l’air par le dioxygène pur permet d’atteindre des températures plus élevées, d’économiser de l’énergie (le volume de diazote non utilisé n’est pas chauffé) et d’éviter la pollution due aux poussières entraînées par le diazote rejeté dans l’atmosphère et à la formation d’oxydes d’azote. Dans les fours de l’industrie verrière, le remplacement de l’air par du dioxygène lors de la combustion permet de diviser par 5 à 10 les émissions d’oxydes d’azote.
- Chimie : dans la production d’oxyde d’éthylène, d’oxyde de propylène, de chlorure de vinyle par oxychloration, de dioxyde de titane par le procédé au dichlore, dans le raffinage des produits pétroliers, pour régénérer des catalyseurs…
- Électronique : pour la fabrication de SiO2 sur les wafers de silicium. Par exemple, Altis Semiconductor, à Corbeil (91), l’ex-usine IBM, consomme par an 160 000 m3 de O2 de haute pureté.
- Santé : dans l’oxygénothérapie pour l’assistance respiratoire, en réanimation, en anesthésie. La consommation humaine est de 3 000 à 5 000 L d’air par 24 heures. Au repos, la consommation est de 0,2 L.min-1, elle passe à près de 4 L.min-1 lors d’un effort intense. L’homme peut respirer une atmosphère contenant entre 14 % et 75 %, en volume, de dioxygène. En dessous de 7 %, des troubles graves apparaissent, en dessous de 3 %, c’est l’asphyxie. Au-dessus de 75 % les symptômes d’hyperoxie apparaissent et il y a danger de mort. De même, O2 est toxique s’il est respiré à une pression supérieure à 0,17 MPa soit sous 7 m de profondeur sous l’eau. 1 g d’hémoglobine peut fixer 1,34 mL de O2 en donnant de l’oxyhémoglobine.
- Blanchiment de la pâte à papier : le dioxygène est utilisé, après lessivage à la soude (voir le chapitre hydroxyde de sodium), afin d’éliminer une partie (environ la moitié) de la lignine restant dans la cellulose. C’est cette lignine qui est responsable de la couleur jaune de la pâte. Ce traitement, appelé cuisson étendue, permet de réduire les quantités de produits de blanchiment employés (Cl2, ClO2, H2O2, O3).
- Découpage et soudage par flammes oxyacétyléniques.
- Retraitement de déchets chimiques.
- Traitement de l’eau : oxygénation de la Seine en aval de Paris, au pont d’Argenteuil, par injection de plus de 200 000 L/h de O2, afin de créer une zone de refuge pour les poissons, en cas de pollution brutale. Voir le chapitre eau.
Dioxygène liquide
Il est utilisé comme comburant de propulsion spatiale. Le moteur Vulcain du premier étage d’Ariane V utilise 27 t de H2 stocké liquide à 20 K et 132 t de O2 stocké liquide à 91 K. La combustion dure 600 secondes. La poussée (1 120 kN) est obtenue par éjection à grande vitesse du gaz (250 kg/s) produit par la combustion à haute pression (108 bar) et haute température (3 500 K). L’alimentation s’effectue selon un débit de 200 L/s de O2 et 600 L/s de H2, la combustion étant effectuée en excès de H2 afin de protéger de l’oxydation les matériaux de la chambre de combustion.
Les réservoirs du lanceur des navettes spatiales américaines contenaient 1 892 500 L de H2 liquide et 1 324 750 L de O2 liquide. De plus, des moteurs auxiliaires à H2 et O2 fournissaient l’électricité de la navette et servaient à l’allumage des moteurs qui ajustaient la trajectoire de la navette et permettaient de revenir sur terre. Dans ce cas, O2 est à 99,999 % et la quantité utilisée est de l’ordre de 50 t. Dans la navette, O2 permettait également de refroidir les 3 ordinateurs de bord et pouvait être vaporisé pour reconstituer l’air respiratoire.
L’oxygène liquide est également, par évaporation, une source de dioxygène gazeux directement utilisable par la clientèle.
L’oxygène liquide a été également utilisé comme explosif en présence de combustibles divers (paraffine, sciure de bois, noir de fumée…). Par exemple, il a été ainsi utilisé, pour la première fois à grande échelle, lors du percement du tunnel du Simplon.
Bibliographie
- Rapports d’activité et informations de Air Liquide, Direction de la communication, 75 Quai d’Orsay, 75321 Paris Cedex 07.
- Rapports d’activité de Linde Gaz Industriels, 523 cours du 3ème millénaire – CS10085, 69792 Saint-Priest Cedex.
- Rapports d’activité de Messer, 25 rue Auguste Blanche, 92816 Puteaux Cedex.
- Rapports d’activité d’Air Products, Parc des portes de Paris, 45 Avenue Victor Hugo, 93534 Aubervilliers.
- M. Bernard, Cours de chimie minérale, Dunod, 1990.
Archives